我司舉辦“新政下保健食品、特醫(yī)食品研發(fā)申報(bào)疑難”研討會(huì)
2017-06-14
2017年6月2-4日,北京中健天行醫(yī)藥分別在北京、杭州兩地與兩協(xié)會(huì)舉辦了“新政下保健食品、特醫(yī)食品研發(fā)申報(bào)疑難”專題研討會(huì),邀請(qǐng)國(guó)家級(jí)技術(shù)審評(píng)專家、新法規(guī)起草人到會(huì)進(jìn)行詳細(xì)講解,深入探討新政下保健食品注冊(cè)申報(bào)審評(píng)、立項(xiàng)研發(fā)及特醫(yī)食品臨床應(yīng)用相關(guān)問題。

(杭州會(huì)場(chǎng))

(北京會(huì)場(chǎng))
北京中健天行醫(yī)藥在兩地會(huì)場(chǎng)中均設(shè)立了申報(bào)咨詢展臺(tái),同時(shí)為企業(yè)提供了《保健食品新法匯編》,受到與會(huì)企業(yè)人員一致好評(píng)和歡迎。以下為會(huì)議講課主要內(nèi)容(如需匯編及課件可與我們聯(lián)系)。


葉祖光教授提到新政下注冊(cè)申請(qǐng)人應(yīng)在3個(gè)月內(nèi)一次提交補(bǔ)充材料,申報(bào)難度及審評(píng)力度加大,注冊(cè)相關(guān)費(fèi)用也明顯提高。葉教授建議企業(yè)使用中醫(yī)經(jīng)典方進(jìn)行配伍,中西合璧,珠聯(lián)璧合。例如增加骨密度:鈣、氨糖等;抗氧化:葡萄籽、維生素E。

林升清強(qiáng)調(diào)新政對(duì)保健食品研發(fā)提出更高要求,只有認(rèn)真進(jìn)行生產(chǎn)研制和研究論證,申報(bào)資料足以證明其安全性、有效性和質(zhì)量可控性的產(chǎn)品才能獲得建議予以注冊(cè),現(xiàn)場(chǎng)核查認(rèn)為無法溯源、復(fù)現(xiàn)或存在重大缺陷的,均可終止審評(píng),建議不予注冊(cè),以減少審評(píng)資源的浪費(fèi)。而備案程序與注冊(cè)程序相比,簡(jiǎn)單很多,備案管理對(duì)產(chǎn)品配方、原輔料名稱及用量、功效、生產(chǎn)工藝等要求制定詳細(xì)統(tǒng)一的規(guī)定,以適應(yīng)各省級(jí)食藥局要求。

范青生教授講到保健食品立項(xiàng)研發(fā)上應(yīng)遵循十大原則,開發(fā)調(diào)研先行、選題思路清晰、配方新穎合理、原料來源合法、有效成分明確、用量安全可靠、依據(jù)充足全面、配方工藝協(xié)調(diào)、原料證明齊全、文獻(xiàn)資料充足。在工藝風(fēng)險(xiǎn)控制方面應(yīng)提供中試以上生產(chǎn)規(guī)模的工藝驗(yàn)證報(bào)告及樣品自檢報(bào)告,無適用的國(guó)家標(biāo)準(zhǔn)、地方標(biāo)準(zhǔn)、行業(yè)標(biāo)準(zhǔn)的原料,應(yīng)提供詳細(xì)的制備工藝、工藝說明及工藝合理性依據(jù)。

呂圭源教授強(qiáng)調(diào)使用原(輔)料不在規(guī)定范圍的,須按照新資源食品的要求進(jìn)行安全性獨(dú)立學(xué)評(píng)價(jià)并提供相關(guān)資料后使用。 原輔料用量方面在保證功能和安全用量范圍內(nèi)建議在《中國(guó)藥典》記載藥物的常用量1/2-1/3范圍內(nèi)(與湯劑、丸劑相比,提取后可以增效,故減少使用劑量)。性味平和的動(dòng)植物物品用量不宜超過國(guó)家相關(guān)標(biāo)準(zhǔn)規(guī)定的上限劑量。如超過上述劑量應(yīng)提供安全依據(jù)文獻(xiàn)。

李可基教授講述了新辦法中保健食品注冊(cè)程序,以受理為注冊(cè)審批起點(diǎn),將現(xiàn)場(chǎng)核查和復(fù)核檢驗(yàn)調(diào)至審評(píng)環(huán)節(jié),由審評(píng)機(jī)構(gòu)統(tǒng)一組織現(xiàn)場(chǎng)核查和復(fù)核檢驗(yàn),使各項(xiàng)流程緊密銜接。注冊(cè)制度最重要的改革是技術(shù)審評(píng)結(jié)論由專家委員會(huì)做出變?yōu)榱擞蓪徳u(píng)中心作出,逐步落實(shí)技術(shù)審評(píng)“內(nèi)審負(fù)責(zé)制”,注冊(cè)難度較以往難度增大很多。
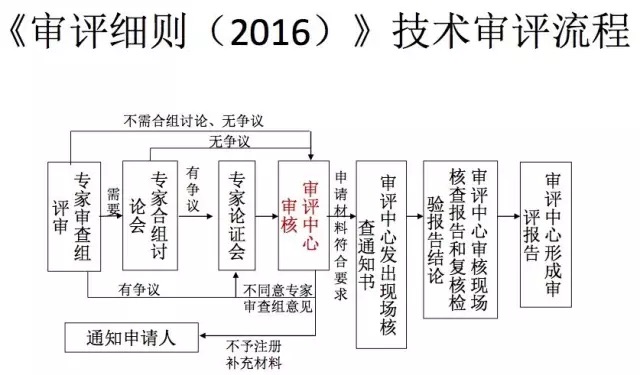

付萍主任報(bào)告中講述保健食品新辦法強(qiáng)化研發(fā)主體責(zé)任,提高保健食品研發(fā)水平和可追溯性的新要求。產(chǎn)品研發(fā)報(bào)告應(yīng)包括研發(fā)人、研發(fā)時(shí)間、研制過程、中試規(guī)模以上的驗(yàn)證數(shù)據(jù),目錄外原料及產(chǎn)品安全性、保健功能、質(zhì)量可控性的論證報(bào)告和相關(guān)科學(xué)依據(jù),以及根據(jù)研發(fā)結(jié)果綜合確定的產(chǎn)品技術(shù)要求等。這就要求我們所提供的研發(fā)報(bào)告必須體現(xiàn)整體研發(fā)思路、過程和可進(jìn)行檢查核實(shí)的結(jié)果,其中的科學(xué)文獻(xiàn)依據(jù)包括科學(xué)文獻(xiàn)、科研試驗(yàn)、權(quán)威信息和統(tǒng)計(jì)數(shù)據(jù)等,并分類、匯總和分析。

陳偉詳細(xì)闡述了特醫(yī)食品的發(fā)展歷程、分類和標(biāo)準(zhǔn),以及與保健食品、膳食補(bǔ)充劑的區(qū)別,著重強(qiáng)調(diào)特醫(yī)食品相關(guān)新法規(guī)嚴(yán)格規(guī)定了生產(chǎn)過程中各項(xiàng)要求,重視控制產(chǎn)品的整個(gè)生產(chǎn)環(huán)節(jié),重點(diǎn)關(guān)注整個(gè)生產(chǎn)過程中微生物的控制,配套的規(guī)范將設(shè)定一定的準(zhǔn)入門檻,企業(yè)進(jìn)入該領(lǐng)域還需多加考慮。

顏崇超博士提到特醫(yī)食品試驗(yàn)實(shí)施條件應(yīng)當(dāng)為藥物臨床試驗(yàn)機(jī)構(gòu),具有營(yíng)養(yǎng)科室和經(jīng)過認(rèn)定的與所研究的特醫(yī)食品相關(guān)的專業(yè)科室,具體開展特醫(yī)食品臨床試驗(yàn)研究條件。臨床開始前需向倫理委員會(huì)提交臨床試驗(yàn)方案、知情同意書、病例報(bào)告表、研究者手冊(cè)以及有法定資質(zhì)的食品檢驗(yàn)機(jī)構(gòu)出具的試驗(yàn)用產(chǎn)品合格的檢驗(yàn)報(bào)告等資料,經(jīng)審議同意方可進(jìn)行臨床試驗(yàn)。
臨床試驗(yàn)用產(chǎn)品由申請(qǐng)人提供,生產(chǎn)條件應(yīng)滿足《特殊醫(yī)學(xué)用途配方食品良好生產(chǎn)規(guī)范》,用于臨床試驗(yàn)用對(duì)照樣品應(yīng)當(dāng)是已獲批準(zhǔn)的相同類別的特定全營(yíng)養(yǎng)配方食品,如無該類產(chǎn)品,可用已獲批準(zhǔn)的全營(yíng)養(yǎng)配方食品或相應(yīng)類別的腸內(nèi)營(yíng)養(yǎng)制劑。