大牌評審專家深入解析保健食品新法研發(fā)申報
2017-04-17

2017年4月8-9日,由中國保健協(xié)會食物營養(yǎng)與安全專業(yè)委員會主辦,北京中健天行醫(yī)藥科技有限公司協(xié)辦的“2017保健食品新法規(guī)研發(fā)申報”專題研討會在京成功舉辦。本次研討會有眾多大牌評審專家出席,深入探討《保健食品注冊與備案管理辦法》及保健食品立項調研、新品研發(fā)、配方配伍、生產工藝等相關內容。

中國中醫(yī)科學院中藥研究所,國家食藥監(jiān)總局保健食品審評專家張保獻在會中,以《基于新的保健食品技術法規(guī)下的生產工藝審評要點》為主題,針對已經正式實施的《保健食品注冊與備案管理辦法》中關于產品的注冊流程、審評流程及研發(fā)報告中生產工藝研究部分做了技術型解析。
張保獻教授提到,《保健食品注冊與備案管理辦法》于2016年7月1日實施以來,主要分為兩類:注冊制與備案制,相對以往的注冊流程做了顛覆性改變,新的審評流程也由專家審評改為內審,原料標準可由企業(yè)研究制定后報省局備案后即可生產,進行全國銷售。
張保獻教授強調,注冊申請人應提供詳細的功效成分或標志性成分檢測方法以及檢測方法的適用性、重現性等方法學研究材料。營養(yǎng)補充劑和純度在98%以上的原料可不提供生產工藝,對除營養(yǎng)補充劑和純度在98%以上的原料外的原料,應提供原料的生產工藝。提取物的生產工藝流程圖要盡量詳細,最好附有工藝說明,注意用酶的種類、注意加工助劑的許可使用與否、注意所用技術有無特殊要求、 注意提取率(出膏率) 、水解應說明酸的種類。

中國中醫(yī)科學院首席研究員,國家食藥監(jiān)總局保健食品審評專家葉祖光在會中,以《中藥保健食品研發(fā)的動態(tài)》為主題,根據《食品安全法》、《保健食品注冊辦法》、《CFDA補充規(guī)定及技術要求有關指導原則》方面展開深入講解。
新的注冊管理辦法當中明確規(guī)定,自發(fā)放《審評意見通知書》電子審評意見后5個工作日開始計時,注冊申請人應在3個月內一次提交補充材料,逾期則將面臨退審,另一方面注冊相關費用也明顯提高,申報難度及監(jiān)管審評力度加大,目前普遍要求做兩個標志性成分,標志性成分需要和功能密切相關。
葉祖光教授提到大部分原料提取物沒有行業(yè)標準或國家標準,常見出現的問題包括(生產工藝不清、得率不準確、使用禁用加工助劑(如二氯甲烷)、使用禁用的原料或部位、添加標志性物質純品、隱瞞實際的工藝、同一提取物不同企業(yè)質量要求差別大),推薦各企業(yè)使用中醫(yī)經典方進行配伍,中西合璧,珠聯璧合。例如骨密度:鈣、氨糖等,抗氧化、美容:葡萄籽、VE。免疫:納豆加靈芝等。

北京中醫(yī)藥大學教授,國家食藥監(jiān)總局保健食品審評專家張貴君在會中,以《保健食品中藥配方原則和產品研發(fā)的相關問題》為主題展開深入講解,其中提到中醫(yī)藥要繼續(xù)發(fā)展下去,必須回到兩千年前,從傳統(tǒng)的中醫(yī)藥理論和臨床實踐中尋找答案。
張貴君教授對相關企業(yè)提出不能強行將某種認為有創(chuàng)新性但沒有食用習慣和保健功能的物質作為某種保健食品研制開發(fā),合成原料慎用、少用,或不用。同時中藥作為原料沒有兒童的劑量,應該引起高度重視!少年兒童應該要有專用的保健食品,1~3歲嬰幼兒不提倡用保健食品。
原輔料的選擇依據方面,注意參考文獻要達到要求的數量(每個原料每項內容3~5篇文獻)合理性:要按照中醫(yī)藥理論論述并有實踐性參考文獻,尤其是申報兩個功能的注意兩個功能的相關性論述。保健食品的原料必須是已知的食品原料,不可標新立異。

原食藥總局保健食品審評中心主任,現中國保健協(xié)會副理事長黃建生在會中,以《保健食品注冊與備案管理辦法》為主題展開深入講解,從辦法的法律依據、備案管理及注冊管理主要涉及內容進行探討。
黃建生提到辦法對保健食品等特殊食品實行嚴格監(jiān)督管理,將保健食品產品上市的管理模式由原來的單一注冊制調整為注冊與備案相結合的分類管理模式。并提出總局和省級局管理的權限。
保健食品許可分類分級管理表


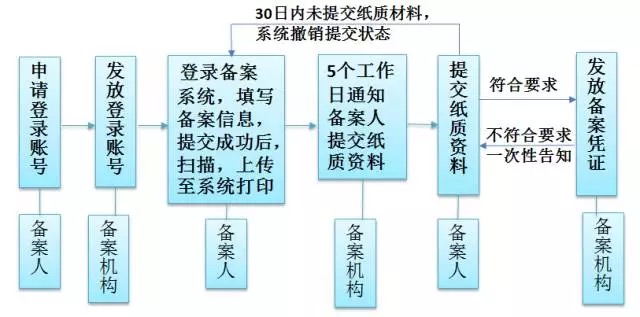
備案產品基本要求應使用已經列入保健食品原料目錄,保健功能已經列入保健食品功能目錄,國產和進口產品都需要10多項材料,備案材料符合要求的,當場備案;不符合要求的,應當一次告知備案人補正相關材料,備案程序與注冊程序相比,簡單了很多,備案管理要對產品配方、原輔料名稱及用量、功效、生產工藝等要求制定詳細統(tǒng)一的規(guī)定,以適應省級食藥局要求,備案工作實施后將會產生很多需要解決的問題。
《備案細則》的備案流程圖

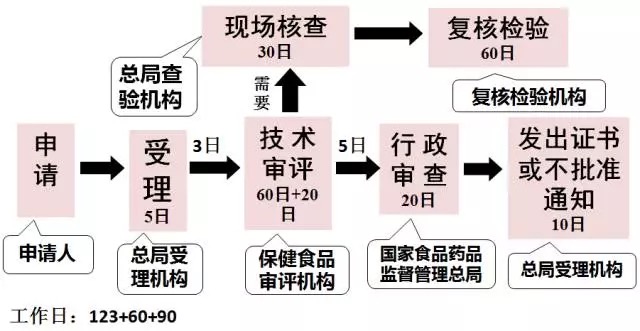
注冊程序方面優(yōu)化了保健食品注冊程序,以受理為注冊審批起點,將現場核查和復核檢驗調至審評環(huán)節(jié),由審評機構統(tǒng)一組織現場核查和復核檢驗,使各項流程緊密銜接,補充資料方面,應當一次告知需要補正的全部內容。注冊制度最重要的改革是技術審評結論由專家委員會做出,變?yōu)榱擞蓪徳u中心作出,注冊難度較以往難度增大很多。
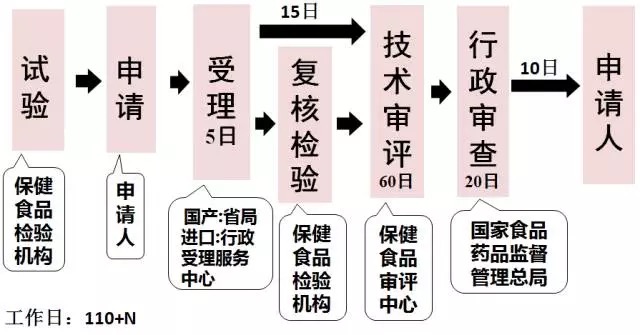
原注冊程序

2016年7月1日執(zhí)行的注冊程序



東南大學公共衛(wèi)生學院教授,國家食藥監(jiān)總局保健食品審評專家孫桂菊在會中分別從《新政下保健食品功能學檢驗與評價》及《保健食品毒理學評價試驗常見問題》展開講解,深入探討新政下保健食品功能評價試驗及毒理學評價試驗。
孫桂菊教授講到安全性和保健功能評價試驗應送往國家指定的檢驗機構檢驗,對送檢的保健食品進行的以驗證保健功能為目的的試驗,包括動物試驗和人群食用評價試驗,出具相應的檢驗報告。
以普通食品、衛(wèi)計委規(guī)定的藥食同源物質、衛(wèi)計委批準的新食品原料為原料生產的,無需進行毒性試驗的保健食品,服用量與常規(guī)用量相同需做急性毒性、三項致突變試驗,服用量大于常規(guī)用量的,還需加做30天喂養(yǎng)試驗,必要時進行傳統(tǒng)致畸試驗和第三階段毒性試驗。由于實驗操作不規(guī)范,根據提供的檢驗報告無法評價產品的安全性,需要做除30天/90天喂養(yǎng)試驗以外的毒理學試驗。